1. 研究背景
软胶原组织(如皮肤、肌腱、心包膜等)以其柔软的外表、却惊人的韧性吸引了生物力学界的广泛关注。以临床常用的牛心包膜(BP)为例,它常用于人类心脏瓣膜替换,能够承受数亿次循环载荷而不断裂,其韧性甚至达到惊人的100 kJ/m²。然而,这种天然材料的强韧来源一直未被彻底揭示。此前开发的合成材料虽有希望替代BP,但因易发生裂纹扩展而难以应用。本研究聚焦BP的微观结构演化与裂纹扩展过程,系统探讨其“高韧性”之源,并为开发仿生材料提供新思路。
2. 本文要点
1. 两种实验策略揭示裂纹桥接机制。研究设计了“纤维拉出实验”与“裂纹扩展实验”两种方法,精确测量裂纹面之间的牵引-分离曲线(traction-separation curve)。结果显示BP的桥接牵引力可达60 MPa,而裂纹最大分离距离高达6 mm,远超硬组织。
2. 多因素调控韧性响应。分别研究了样本高度、胶原纤维排列方向与脱水处理对韧性行为的影响。发现当纤维沿加载方向排列时牵引力最大,而垂直排列时裂纹扩展最迅速;脱水处理虽增强牵引强度(至~102 MPa),但显著降低裂纹分离距离。
3. 揭示结构与功能耦合机制。通过多光子显微成像与扫描电镜观察,作者描绘了BP中胶原纤维的去弯曲、重定向与滑移过程,提出BP之所以“坚韧”,是因其软基体中嵌入了能长距离传递张力的强韧纤维网络。这种架构赋予其高断裂能和缺陷不敏感性。

图1. BP膜来源、实际照片及其胶原-弹性蛋白网络结构与分层示意

图2. 展示裂纹扩展过程中胶原纤维的桥接行为

图3. 说明纤维拉出实验设计、过程与牵引-分离曲线

图4. 拉出实验中显微镜下胶原纤维从去弯曲至拉出的全过程图像
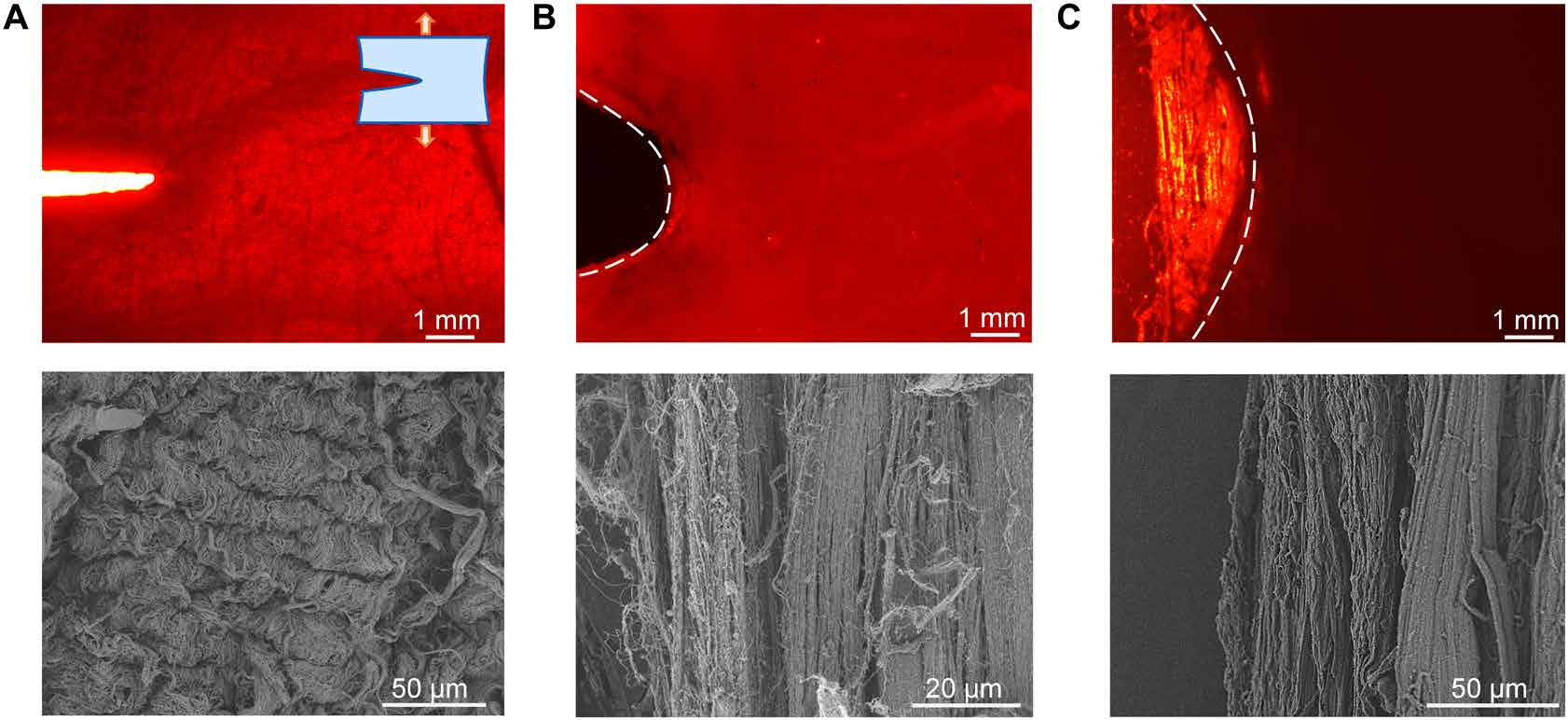
图5. 极化光与电镜下的裂纹尖端形貌演化

图6. 通过裂纹增长实验获得能量释放率与牵引曲线
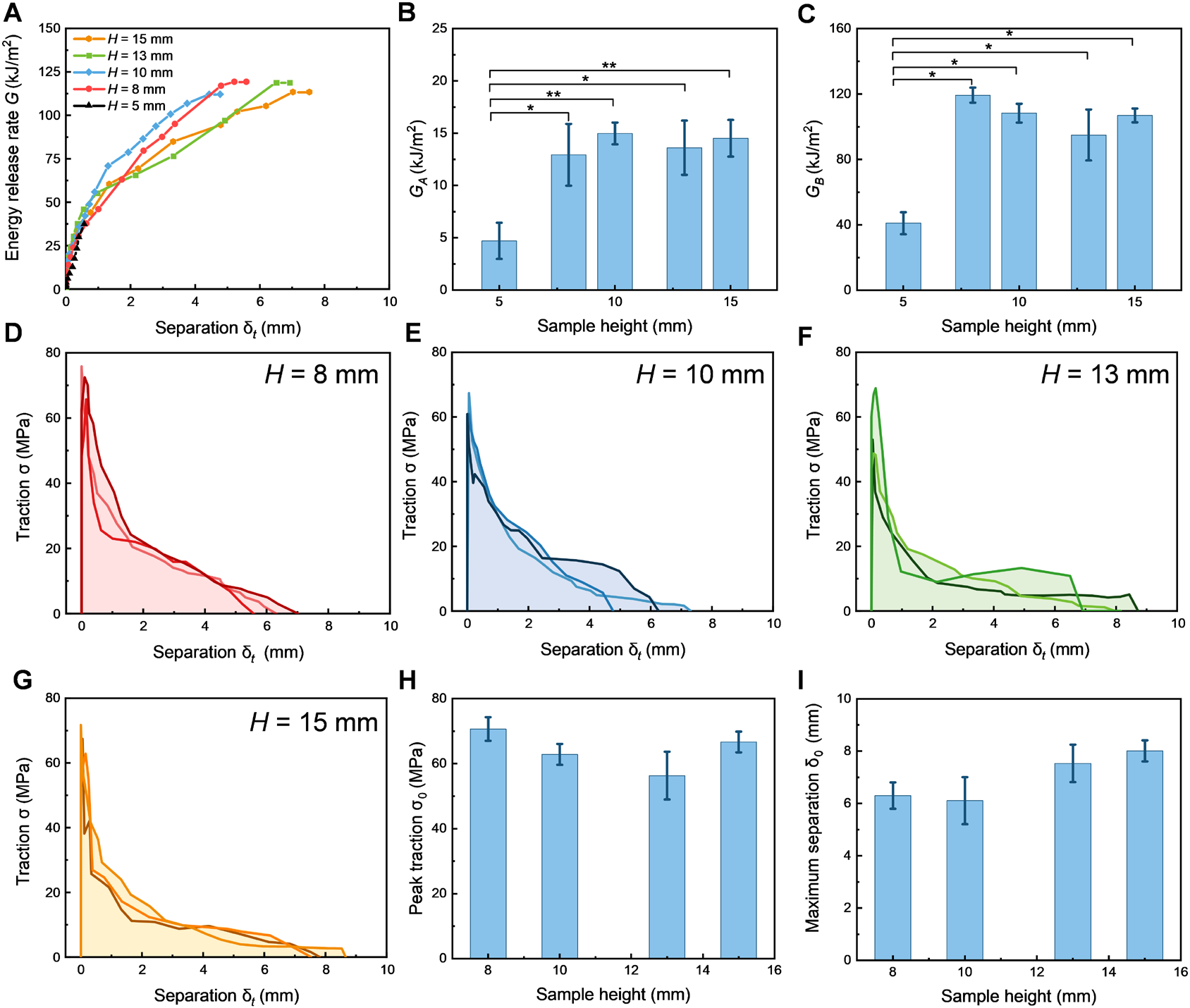
图7. 不同样本高度对牵引-分离曲线的影响
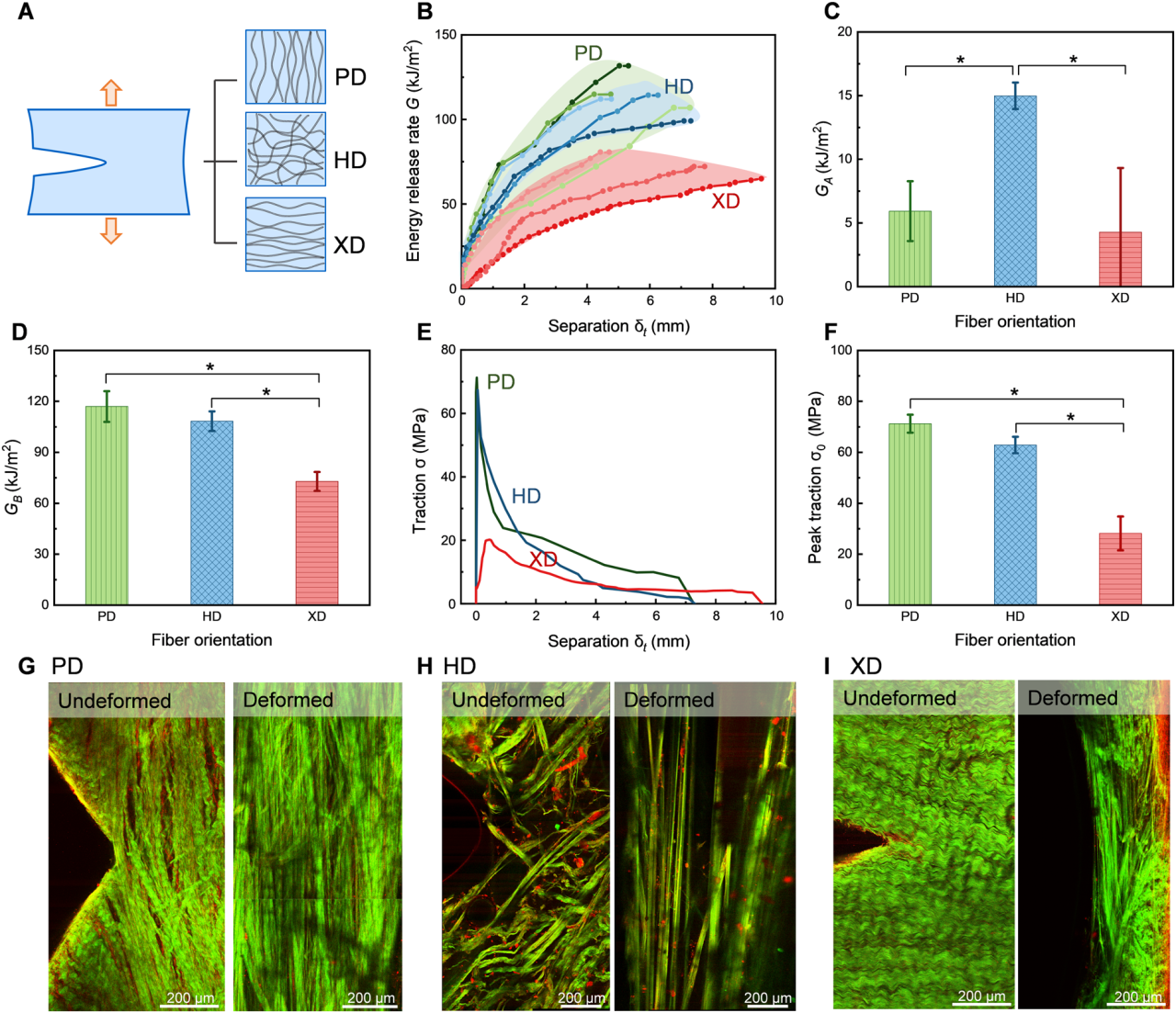
图8. 不同纤维排列方向对裂纹扩展行为和牵引强度的影响

图9. 脱水处理下裂纹增长路径变化与牵引能力下降

图10. BP与其他软/硬组织、合成材料在韧性参数空间的对比分析图
3. 研究结论
本研究揭示了BP组织之所以拥有异常高韧性的关键机制:长而强的胶原纤维在裂纹尖端形成“桥接区”,通过去弯曲、重定向与滑移等过程,传递高牵引力并阻止裂纹快速扩展。两类实验均测得最大牵引力约60 MPa,最大分离距离达6 mm,表现出比骨骼、贝壳等硬组织高2–4个数量级的裂纹分离能力。纤维排列方向显著影响牵引力响应,而脱水则引起纤维“拉断”而非“拉出”,虽提升牵引力但降低了裂纹扩展能力。研究还指出BP具有优异的“裂纹不敏感性”,其裂纹传播长度(fractocohesive length)为10–50 mm,远高于传统材料。这一裂纹桥接机制与结构调控理念为开发高韧仿生复合材料提供了理论基础与工程路线。
4. 文章信息
Jingyuan Tang, Xi Chen, Fengkai Liu, Liangsong Zeng, Zhigang Suo*, Jingda Tang*. Why are soft collagenous tissues so tough?
Science Advances, 11, eadw0808 (2025).
https://doi.org/10.1126/sciadv.adw0808
